
市場規模
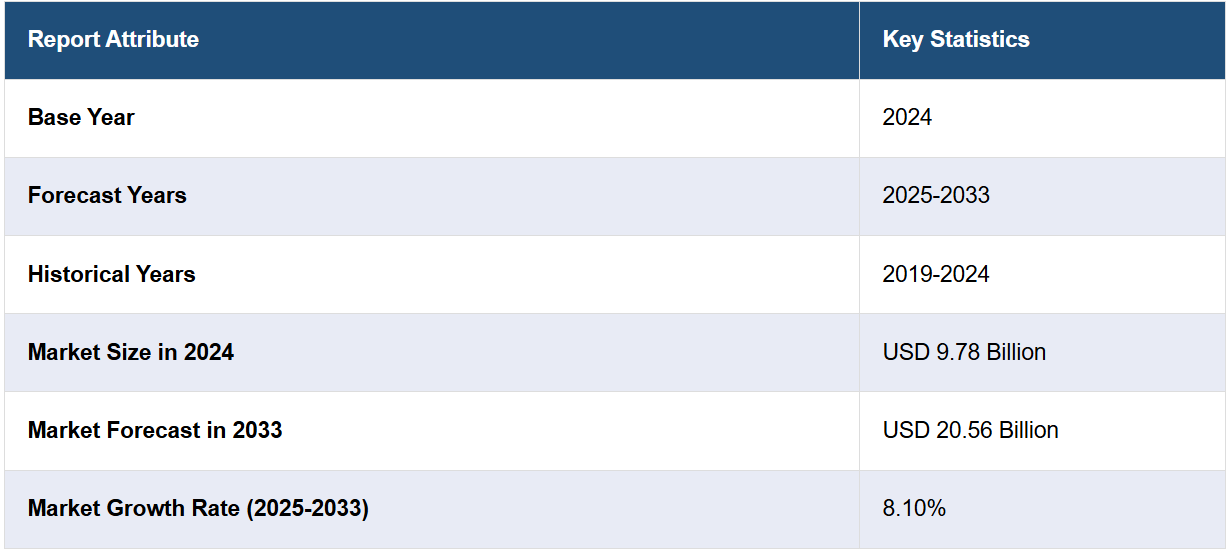
世界の医薬品薬事申請市場規模は、2024年には97.8億米ドルと評価された。今後、IMARC Groupは、2033年までに市場規模が205.6億米ドルに達し、2025年から2033年の年間平均成長率(CAGR)は8.10%になると予測している。医薬品業界は、厳格な安全性および有効性基準に牽引され、規制要求の高まりに直面している。地域差、生物製剤や先進療法に関するガイドラインの進化、頻繁な更新などに対応するには、強固な規制戦略が必要です。この複雑性により、コンプライアンスの確保、承認の合理化、グローバル市場参入の課題への効果的な対応を可能にする、熟練した専門家の需要が高まっています。
医薬品薬事申請関連市場は、世界的な規制枠組みの複雑化によって牽引されています。 食品医薬品局(FDA)、指数平滑移動平均(EMA)、世界保健機関(WHO)などの規制当局は、医薬品の安全性、有効性、品質を確保するために、コンプライアンス基準の強化を続けています。これにより、多様な承認プロセスをナビゲートし、地域ごとの要件の相違に対応するための規制に関する専門知識に対する需要が高まっています。 患者の安全性への注目が高まり、新薬申請や生物製剤の数が増加していることから、綿密な文書化とコンプライアンス戦略の必要性も高まっています。 さらに、先進療法やデジタルヘルス技術に関するガイドラインを含む規制の頻繁な更新により、製薬会社は強固な薬事チームとコンサルティングサービスへの投資を余儀なくされ、市場の成長をさらに促進しています。
米国は、医薬品薬事申請市場において極めて重要な役割を果たしており、その市場シェアは83.60%に達しています。これは、FDAが定める厳格な基準によるものです。2023年には、FDAが55の新薬を承認し、これは近年で2番目に多い数となりました。医薬品イノベーションの世界的リーダーである米国の規制環境は、医薬品承認、臨床試験、市販後調査に対する厳しい要件によって特徴付けられます。生物製剤、先進療法、デジタルヘルスソリューションの台頭により、コンプライアンスプロセスはさらに複雑化し、薬事規制の専門家への依存度が高まっています。 また、FDAによる画期的治療薬指定などのプログラムを通じた医薬品承認期間の合理化やイノベーションの促進といった政策の進化も市場に影響を与えています。 さらに、米国市場はジェネリック医薬品やバイオシミラー医薬品に関する大量の申請によって形成されており、正確な規制戦略が必要とされています。
医薬品薬事申請市場のトレンド:
規制プロセスのデジタル変革
デジタルツールの採用により、製薬業界の薬事規制は革命的な変化を遂げ、複雑なデータのより効率的な管理が可能になりました。FDAのeCTDによる電子申請やAI主導の分析により、文書処理の合理化とコンプライアンスのモニタリングが可能になりました。日常的な書類作成や規制の更新状況の追跡は自動化され、人的エラーを最小限に抑え、スピードが向上します。 現在、臨床試験やサプライチェーンの文書化におけるセキュリティと透明性を向上させるために、ブロックチェーン技術の活用が進んでいます。 このような進歩により、業務ワークフローの最適化と、グローバルな規制当局とのリアルタイムでの連携が確保され、コンプライアンスの変化に迅速に対応できるようになります。 業界全体がデジタル変革へとシフトしつつあり、これにより規制へのコンプライアンスが確保されるだけでなく、新製品の市場投入までの時間が短縮されます。
グローバルな規制の調和に対する高まる重視
医薬品薬事申請市場では、地域ごとの規制枠組みの調和に向けた取り組みがいくつか出てきています。ICHは、医薬品承認のための作業の重複を減らし、統一ガイドラインの開発と確立を試みる国際機関です。これにより、国境を越えた臨床試験が簡素化され、製品の発売につながります。この調和により、医薬品はグローバル市場への参入が容易になります。しかし、実施スケジュールや現地の要件には依然として大きなばらつきがあるため、標準化された規制と地域特有の規制の両方を乗り切るための専門知識が求められます。この傾向は、グローバルな機会を活用しながらコンプライアンスを維持することの重要性を強調しており、薬事規制の領域における専門的役割とコンサルティングサービスの開発を推進しています。
先進療法と生物製剤に注目
生物製剤、遺伝子治療、個別化医療の市場が拡大するにつれ、医薬品薬事申請の状況も変化しています。 このような先進的な治療法では、従来の枠組みではこれらの新しい特性に十分に対応できないため、新たな規制の枠組みが必要になることがよくあります。 FDAやEMAなどの機関は、進化する科学的データに対応するための適応型承認プロセスを含め、細胞療法や遺伝子治療製品向けの専門ガイドラインを導入しています。 この傾向により、新たな規制に対するより深い理解と規制当局との緊密な連携が必要になっています。生物製剤や先進療法のパイプラインが増加するにつれ、コンプライアンスの複雑化が浮き彫りになり、規制戦略の革新が促され、こうした変革的な治療カテゴリーに対応できる専門家の需要が拡大しています。
医薬品薬事申請業界のセグメンテーション:
IMARC Groupは、世界の医薬品薬事申請市場の各セグメントにおける主要なトレンドの分析を提供しており、2025年から2033年までの世界、地域、国レベルでの予測も行っています。市場はサービスプロバイダー、サービス、カテゴリー、適応症、展開段階、企業規模に基づいて分類されている。
サービスプロバイダー別分析
社内
アウトソーシング
アウトソーシングは、手頃な価格で特定の専門知識へのアクセスを可能にするため、2024年には市場の約61.3%を占める最大の構成要素となる。企業は、合理化された業務に伴う間接費を最小限に抑え、コアコンピタンスを最適化するために、アウトソーシング活動にますます好んで取り組むようになっている。コンプライアンス業務、文書化、申請の完了には広範な専門知識が必要であり、大規模な規制プロセスは多大なリソースを消費するため、アウトソーシングが重要となります。 また、アウトソーシングは、柔軟性と拡張性を提供し、多様なグローバル規制環境の迅速なナビゲーションを可能にします。 この傾向は、医薬品承認プロセスの複雑化と、進化する規制に対応するための継続的なアップデートの必要性によってさらに加速しています。 その結果、アウトソーシングは好ましいソリューションとして浮上し、市場の大きなシェアを獲得しています。
サービス別分析
規制コンサルティング
法的代理
薬事関連文書の作成および出版
ライティング
出版
製品登録および臨床試験申請
その他
薬事関連文書の作成および出版は、薬事申請に必要な正確かつコンプライアンスに準拠した文書作成の需要の高まりにより、2024年には市場シェアの約37.6%を占め、市場をリードする見通しです。このセグメントでは、臨床試験プロトコル、治験薬概要書、規制関連書類の作成など、厳格なグローバル基準への準拠を確保する重要な機能がカバーされています。医薬品開発活動の増加と承認プロセスの複雑化に伴い、製薬会社は正確な報告を行うための専門サービスに大きく依存するようになっています。さらに、電子申請の採用とガイドラインの進化により、専門的なライティングおよびパブリッシングソリューションのニーズはさらに高まっています。これらの要因が相まって、レギュラトリー・ライティングおよびパブリッシングは市場の重要な要素となっています。
カテゴリー別分析
医薬品
イノベーター
ジェネリック
生物製剤
バイオテクノロジー
ATMP
バイオシミラー
2024年には、医薬品が市場の大半を占めるようになります。これは、医療技術革新における重要な役割が主な要因です。これは主に、膨大な数の新薬申請、厳しい規制要件、複雑な承認プロセスによって推進されています。製薬会社にとって、医薬品はポートフォリオ全体の中でかなりの割合を占めています。そのため、絶えず進化するグローバルスタンダードへの準拠に多額の費用を投じています。さらに、綿密な文書化、臨床試験データ、承認後のモニタリングの必要性から、薬事関連業務の需要が高まっています。また、特殊な医薬品、生物製剤、個別化医療もこの分野の重要性を高める要因となっており、市場で最大のカテゴリーとなっています。これらの要因は、医薬品に対する規制面のサポートの重要性を強調しています。
適応症別分析
腫瘍学
神経学
心臓学
免疫学
その他
腫瘍学は、がんの有病率の増加と、それに対応する革新的な治療法の研究開発の急増により、市場全体の32.5%を占める最大の市場セグメントとなりました。 がん治療の複雑性と包括的な安全性および有効性データの必要性により、腫瘍学の薬剤の規制プロセスは特に厳格です。企業は承認を迅速化し、救命治療への需要に応えるために、規制順守を優先しています。さらに、免疫療法、標的治療、生物製剤の進歩により、この分野への申請件数が増加しています。未充足の医療ニーズへの対応と、進化するグローバルガイドラインへの対応に重点的に取り組むことで、オンコロジーは薬事規制における主要な市場セグメントとしての地位をさらに強固なものにしています。
開発段階別分析
前臨床
臨床
市販後承認(PMA
臨床は、厳格な規制基準への準拠が不可欠な医薬品開発プロセスにおいて臨床試験が極めて重要であることから、2024年には市場シェアの約48.2%を占め、市場をリードしています。この段階における規制当局の監督は、臨床試験の安全性、有効性、倫理的な実施を確保することを目的としており、綿密な文書化と国際的なガイドラインの順守が求められます。臨床試験の複雑化とグローバルな提携の増加に伴い、専門的な規制当局の支援の必要性が高まっています。さらに、臨床試験デザインの進歩と個別化医療の台頭も、このセグメントの成長に寄与しています。これらの要因により、臨床試験段階は規制当局にとって重要な要素となり、市場シェアの大幅な拡大につながっています。
企業規模別の分析
小規模
中規模
大規模
中規模企業は、機敏さと臨機応変さをバランスよく兼ね備えた独自の能力により、複雑な規制環境を効果的にナビゲートできるというリーダーシップの資質により、2024年には市場シェアの約46.1%を占め、市場をリードしています。大企業とは異なり、中規模企業は合理化された意思決定プロセスから利益を得ており、これにより進化するグローバル規制への適応力が強化されています。さらに、専門知識を活用するためにアウトソーシングをますます活用し、過剰なコストをかけずにコンプライアンスを確保しています。 これらの企業は、ニッチ市場や革新的な医薬品分野に重点的に取り組んでいることが多く、カスタマイズされた規制ソリューションの需要を促進しています。 グローバルな事業拡大と高い業務効率の維持に向けた戦略的投資は、市場での存在感の向上にさらに貢献し、2024年には市場リーダーとしての地位を確固たるものにしています。
地域分析:
北米
米国
カナダ
アジア太平洋地域
中国
日本
インド
韓国
オーストラリア
インドネシア
その他
ヨーロッパ
ドイツ
フランス
英国
イタリア
スペイン
その他
中南米
ブラジル
メキシコ
その他
中東およびアフリカ
主要地域からの結論:
米国の医薬品薬事申請市場分析
米国は、高度に体系化され、厳格な規制枠組みにより、医薬品薬事申請市場を独占している。主にFDAの規制下にあるこの市場は、医薬品承認、臨床試験、市販後調査に関する厳格な基準を特徴としている。生物製剤、個別化医療、デジタル治療における技術革新は、コンプライアンスプロセスを複雑化させ、熟練した規制関連の専門家の需要を大幅に高めている。画期的治療薬指定や迅速承認プログラムなどのイニシアティブは、新規治療薬の開発を効率化しますが、複雑な規制経路を正確にナビゲートする必要があります。さらに、米国市場ではジェネリック医薬品やバイオシミラー医薬品に対する申請が大量に発生しており、専門知識の必要性はさらに高まっています。進化する規制政策やeCTDのようなデジタルツールの統合は効率性を高めていますが、地域差の管理における課題は依然として残っています。
欧州の医薬品薬事申請関連市場分析
欧州は欧州医薬品庁(EMA)の指導のもと、医薬品薬事申請市場において重要な地位を占めています。この地域では、相互認証手続きや中央承認プロセスなどのメカニズムを通じて規制の調和が図られ、国境を越えた医薬品承認が簡素化されています。先進療法やバイオシミラーが市場成長を牽引しており、先進療法医薬品(ATMP)などの専門ガイドラインの順守が求められています。さらに、電子申請のための eCTD やコンプライアンスモニタリングのための AI などのデジタルツールの採用により、規制プロセスの効率性と正確性が向上しています。しかし、ブレグジットにより複雑さが増し、企業は EU と英国の 2 つのコンプライアンス枠組みを管理する必要が生じています。こうした課題があるにもかかわらず、欧州の規制環境は進化を続けており、医薬品の安全性と品質に関する厳格な基準を確保しながら、イノベーションを支援しています。
アジア太平洋地域の医薬品薬事申請市場分析
アジア太平洋地域の医薬品薬事申請市場は、臨床試験の増加と中国やインドなどの国々における医薬品製造ハブの確立により、著しい成長を遂げています。この地域の多様な規制システムは課題を提起しており、企業はさまざまな基準や承認プロセスに適応する必要があります。しかし、ASEAN共通技術資料や国際整合化イニシアティブなどの調和に向けた継続的な取り組みにより、コンプライアンスの負担が軽減され、地域統合が促進されています。急速に拡大する市場とバイオシミラーや革新的な医薬品への投資の増加が相まって、規制に関する専門知識の重要性がさらに強調されています。企業は、進化する規制や市場特有の要件へのコンプライアンスを確保しながら、成長機会を最大限に活用するために、ダイナミックな環境の把握にますます重点を置くようになっています。
ラテンアメリカ医薬品薬事申請市場分析
ラテンアメリカの医薬品薬事申請市場は、ブラジルのANVISAやメキシコのCOFEPRISなどの主要機関が主導する進化する規制枠組みに牽引され、成長しています。これらの組織は、バイオシミラーやジェネリック医薬品の開発と承認をサポートするための基準を推進しており、これらの医薬品は、この地域のヘルスケアの状況においてますます重要なものとなっています。 現地での医薬品製造の増加は、規制遵守の専門知識に対する需要を高めています。 国際的なベストプラクティスの導入など、規制の近代化とグローバルスタンダードとの整合に向けた取り組みは、市場へのアクセスと業務効率を改善し、医薬品の承認を合理化し、ラテンアメリカ全域での業界の成長を促進しています。
中東およびアフリカの医薬品薬事申請市場分析
中東およびアフリカの医薬品薬事申請関連市場は、各国の多様な規制枠組みの影響を受けており、課題と機会の両方を提示しています。この地域の政府は、外国からの投資を誘致し、必須医薬品へのアクセスを向上させるために、積極的に規制の近代化を進めています。この近代化は、成長を続ける医薬品製造部門と、医療需要を満たす上で重要なジェネリック医薬品への注目度の高まりを支えています。その結果、急速に進化し、戦略的に重要なこの地域において、複雑なコンプライアンスプロセスをナビゲートし、効率的な市場参入を促進する、熟練した規制関連の専門家のニーズが急増しています。
競合状況
医薬品薬事申請市場の競争環境は、グローバルなコンサルティング企業、薬事規制専門企業、製薬会社内の薬事規制チームなど、多様なプレイヤーの存在によって特徴づけられます。主要なプレイヤーには、さまざまな地域で包括的な薬事規制サービスを提供する医薬品開発業務受託機関(CRO)や薬事規制コンサルティング企業が含まれます。これらの企業は、複雑な規制枠組みのナビゲーション、コンプライアンスの確保、市場参入の促進に関する専門知識を提供しています。医薬品ポートフォリオ、生物製剤、先進療法の拡大により、規制に関する専門知識の需要が高まる中、企業はAI駆動のコンプライアンスソリューションなどのデジタルツールを含む専門サービスを提供することで差別化を図っています。さらに、規制当局とのパートナーシップやグローバル市場参入戦略に関する専門知識は、急速に進化するこの分野で競争力を維持するために不可欠です。
本レポートでは、医薬品薬事申請市場における競争環境について包括的な分析を行い、以下を含むすべての主要企業の詳しいプロフィールを提供しています。
チャールスリバー・ラボラトリーズ・インターナショナル社
Freyr
ICON plc
IQVIA Inc
Parexel International (MA) Corporation
Pharmalex GmbH
Pharmexon
WuXi AppTec
最新ニュースと動向:
2024年10月、ISPE規制品質調和委員会は、医薬品薬事申請における最近の更新事項を強調しました。EU委員会は、透明性と小児試験結果に焦点を当てた臨床試験規則(EU)No 536/2014の改訂版を公表しました。欧州医薬品庁(EMA)は、医薬品の環境リスク評価に関するガイドラインを更新し、2024年9月より有効としました。さらに、EMAは、リスクレベル別に分類し、規制および品質管理に関するガイダンスを提供する、共処理添加物(CoPE)に関する新たなQ&Aを公表しました。
2024年5月、BIRACはインドのバイオテクノロジー部門におけるイノベーションを支援するため、5月17日に開催されたBioNest Conclaveにおいて、規制および政策擁護部門を立ち上げた。この部門は、規制上の課題の解決、グローバルな規制の調和、およびスタートアップ企業や中小企業に有益な政策の擁護を目指している。CDSCO、FSSAI、NITI Aayog、その他の利害関係者と協力し、支援的なエコシステムを育成し、バイオテクノロジーの成長を促進し、研究室での研究を市場に投入できる製品へと移行させることを目指します。
2024年5月、薬学部は、HCI大学院ディプロマコースを優秀な成績で修了した学生(2等級優等学位1級以上)を対象に、薬事規制科学修士課程を開設しました。30単位の論文モジュールでは、産業界での研修や学術的な環境を通じて、実践的な研究経験を積むことができます。コースディレクターのパトリック・オドワイアー博士は、このプログラムが、ATMPやビッグデータなど、新興分野のニーズに対応しており、規制や品質に関する役割についての「バイオ医薬品のためのスキル」レポートの調査結果と一致している点を強調しました。
【目次】
1 序文
2 範囲と方法論
2.1 本調査の目的
2.2 利害関係者
2.3 データソース
2.3.1 一次ソース
2.3.2 二次ソース
2.4 市場推定
2.4.1 ボトムアップアプローチ
2.4.2 トップダウンアプローチ
2.5 予測方法
3 エグゼクティブサマリー
4 グローバル医薬品薬事申請市場 – はじめに
4.1 医薬品薬事申請とは
4.2 業界動向
4.3 競合情報
5 世界の医薬品薬事申請市場の概観
5.1 過去の市場動向と現在の市場動向(2019年~2024年
5.2 市場予測(2025年~2033年
6 世界の医薬品薬事申請市場 – サービスプロバイダー別内訳
6.1 社内
6.1.1 概要
6.1.2 過去の市場動向および現在の市場動向(2019年~2024年
6.1.3 市場予測(2025年~2033年
6.1.4 サービス別市場内訳
6.1.5 カテゴリー別市場内訳
6.1.6 適応症別市場内訳
6.1.7 開発段階別市場内訳
6.1.8 企業規模別市場内訳
6.2 アウトソーシング
6.2.1 概要
6.2.2 過去の市場動向と現在の市場動向(2019年~2024年
6.2.3 市場予測(2025年~2033年
6.2.4 サービス別市場内訳
6.2.5 カテゴリー別市場内訳
6.2.6 適応症別市場規模推移
6.2.7 開発ステージ別市場規模推移
6.2.8 企業規模別市場規模推移
6.3 サービスプロバイダー別の魅力的な投資提案
…
【お問い合わせ・ご購入サイト】
資料コード:SR112025A27613
